ALCOHOLES Y FENOLES

Por medio de este blog dare a conocer como se pueden nombrar los alcoholes y fenoles teniendo en cuenta la nomenclatura y reglas vistas desde el primer periodo, para continuar aprendiendo sobre la nueva nomenclatura dichos compuestos, en donde debemos tener en cuenta cadenas principales, enumerando y analizando que nombre se le debe dar, de acuerdo a sus condiciones y importancia en la cadena de carbonos, pues su nombre varia de acuerdo a su posicion. Para esto la profesora nos facilita una aplicacion virtual con la que podemos interactuar mediante un cuestionario para relacionar la cadena con su respectivo nombre y tambien de igual manera prepararnos para la evaluacion final.
1. Aprender la nomenclatura de los alcoholes y fenoles para poder dar solucion a ejercicios en los que se tengan que nombrar.
2. Conocer cuales son las reglas y nombres que se deben poner en cada caso.
3. Aprender las estructuras y clasificacion de los alcoholes
4.Tener en cuenta la nomenclatura IUPAC y asi mismo su forma estructural
5. Saber cuales son las propiedades quimicas y fisicas de los fenoles
 |
Se denomina alcohol a aquellos compuestos químicos orgánicos, hidrocarburos saturados, o alcanos que contienen un grupo hidroxilo en sustitución de un átomo de hidrógeno enlazado de forma covalente a un átomo de carbono, son caracterizados por la presencia de uno o mas grupos -OH (hidroxilo) como grupo principal. Los alcoholes tienen de formula general: R-OH, estructuralmente son semejantes al agua, en donde uno de los hidrógenos se ha sustituido por un grupo alquilo. Su grupo funcional es el grupo hidroxilo, OH.
Se denomina alcohol a aquellos compuestos químicos orgánicos, hidrocarburos saturados, o alcanos que contienen un grupo hidroxilo en sustitución de un átomo de hidrógeno enlazado de forma covalente a un átomo de carbono, son caracterizados por la presencia de uno o mas grupos -OH (hidroxilo) como grupo principal. Los alcoholes tienen de formula general: R-OH, estructuralmente son semejantes al agua, en donde uno de los hidrógenos se ha sustituido por un grupo alquilo. Su grupo funcional es el grupo hidroxilo, OH.
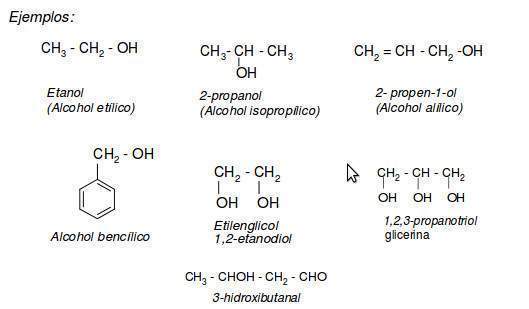
Se nombran sustituyendo la terminación de los alcanos -ano por -ol. Se toma como cadena principal la más larga que contenga el grupo hidroxilo y se numera otorgándole el localizador más bajo.
1. Común (no sistemática): anteponiendo la palabra alcohol y sustituyendo el sufijo -ano del correspondiente alcano por -ílico. Así por ejemplo tendríamos alcohol metílico, alcohol etílico, alcohol propílico, etc.
2. El sistema IUPAC nombra a los alcoholes de acuerdo a las siguientes reglas:
- Se busca la cadena más larga que incluya el Grupo Hidroxilo. La terminación o del hidrocarburo se cambia por -o
- La cadena se numera de forma que al grupo funcional le corresponda el menor número posible. Si hay mas de un grupo hidroxilo en la cadena, se emplean los prefijos di, tri, etc.
- Cuando el alcohol no es el grupo funcional principal se nombra como hidroxi, precedido de su número localizador
- Cuando el grupo alcohol es sustituyente, se emplea el prefijo hidroxi-. Se utilizan los sufijos -diol, -triol... según la cantidad de grupos OH que se encuentre.
 |

Alcoholes primarios, secundarios y terciarios
1. Alcohol primario: los alcoholes primarios reaccionan muy lentamente. Como no pueden formar carbocationes, el alcohol primario activado permanece en solución hasta que es atacado por el ión cloruro. Con un alcohol primario, la reacción puede tomar desde treinta minutos hasta varios días.
2. Alcohol secundario: los alcoholes secundarios tardan menos tiempo, entre 5 y 20 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
3. Alcohol terciario: los alcoholes terciarios reaccionan casi instantáneamente, porque forman carbocationes terciarios relativamente estables.
Propiedades generales
Los alcoholes son líquidos incoloros de baja masa molecular y de olor característico, solubles en el agua en proporción variable y menos densos que ella. Al aumentar la masa molecular, aumentan sus puntos de fusión y ebullición, pudiendo ser sólidos a temperatura ambiente (p.e. el pentaerititrol funde a 260 ºC).
También disminuye la solubilidad en agua al aumentar el tamaño de la molécula, aunque esto depende de otros factores como la forma de la cadena alquílica. Algunos alcoholes (principalmente polihidroxílicos y con anillos aromáticos) tienen una densidad mayor que la del agua. Sus puntos de fusión y ebullición suelen estar muy separados, por lo que se emplean frecuentemente como componentes de mezclas anticongelantes. Por ejemplo, el 1,2-etanodiol tiene un p.f. de -16 ºC y un p.eb. de 197 ºC.
Propiedades químicas de los alcoholes
Las propiedades químicas de los alcoholes están relacionados con el grupo -OH, que es muy polar y capaz de establecer puentes de hidrógeno con sus moléculas compañeras, con otras moléculas neutras, y con aniones.

Los monoalcoholes derivados de los alcanos responden a la fórmula general CnH2n+1OH. Por otro lado, Los alcoholes son ácidos, el hidrógeno del grupo -OH tiene un pKa de 16.
 |
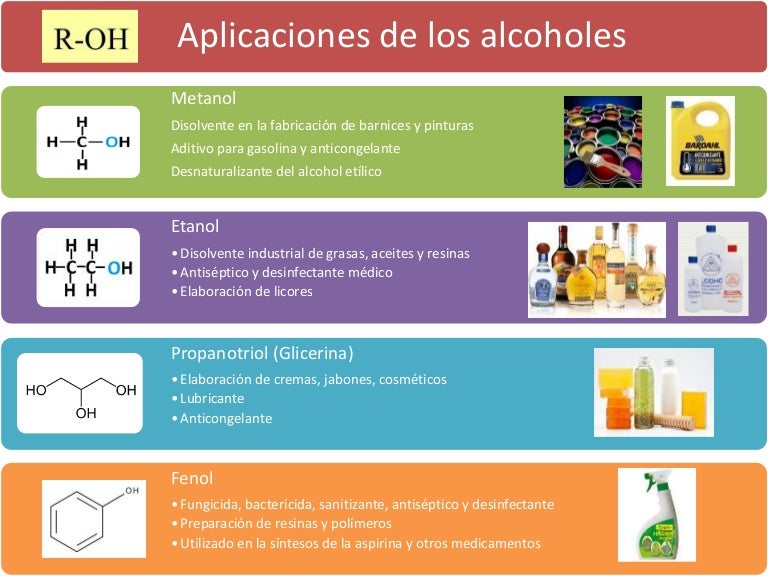
1. Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla. Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánica.
2. El etanol se utiliza ampliamente en muchos sectores industriales y en el sector farmacéutico, como excipiente de algunos medicamentos y cosméticos (es el caso del alcohol antiséptico 70º GL y en la elaboración de ambientadores y perfumes). Es muy utilizado con fines culinarios (bebida alcohólica).
3. Es un buen disolvente, y puede utilizarse como anticongelante. También es un desinfectante. Su mayor potencial bactericida se obtiene a una concentración de aproximadamente el 70%.
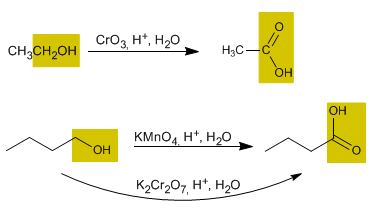
Oxidación de alcoholes
1. Alcohol primario: se utiliza la Piridina (Py) para detener la reacción en el aldehído Cr03 / H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.
2. Alcohol secundario: se obtiene una cetona + agua.
3. Alcohol terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza uno enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
 |
Síntesis de alcoholes
Se obtienen mediante sustitución nucleófila y por reducción de aldehídos y cetonas. El ataque de reactivos organometálicos a electrófilos -carbonilos, epoxidos, esteres- es un método importante en la síntesis de alcoholes.
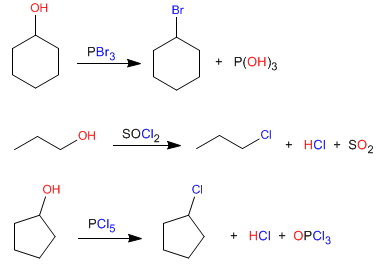
Obtención de haloalcanos a partir de alcoholes
Los alcoholes se transforman en haloalcanos por reacción con PBr3. El mecanismo es del tipo SN2 y requiere alcoholes primarios o secundarios.
 |
Deshidratación de alcoholes
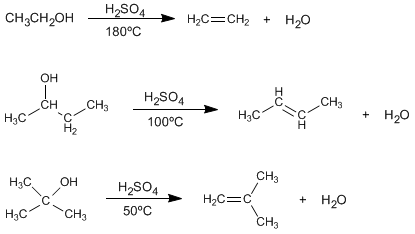
La deshidratación de alcoholes es el proceso químico que consiste en la conversión de un alcohol en un alqueno por proceso de eliminación. Para realizar este procedimiento se utiliza un ácido mineral para extraer el grupo hidroxilo (OH) desde el alcohol, generando una carga positiva en el carbono del cual fue extraído el OH el cual tiene una interacción eléctrica con los electrones más cercanos (por defecto, electrones de un hidrógeno en el caso de no tener otro sustituyente) que forman un doble enlace en remplazo.
 |
Son compuestos orgánicos aromáticos que en su estructura y fórmula química poseen el grupo hidroxilo. En el medio ambiente no existen solos ya que son productos del metabolismo de los seres vivos, ademas el fenol es una sustancia blanca, cristalina a temperatura ambiente, de color blanco-incoloro con un olor distintivo, acre y aromático.
La obtención de los fenoles es a partir de la oxidación con aire, en donde una vez producida esta reacción química se convierte en acetona y fenol, ambos compuestos químicos también con diversos usos industriales y medicinales. Para conseguirlos por separado es frecuente utilizar el proceso llamado destilación.
Propiedades fisicas
Su Fórmula química es C6H5OH, y tiene un Punto de fusión de 43 °C y un Punto de ebullición de 182 °C. El fenol no es un alcohol, debido a que el grupo funcional de los alcoholes es R-OH,y en el caso del fenol es Ph-OH. El fenol es conocido también como ácido fénico o ácido carbólico, cuya Ka es de 1,3 • 10-10. Se puede detectar el sabor y el olor del fenol a niveles más bajos que los asociados con efectos nocivos. El fenol se evapora más lentamente que el agua y una pequeña cantidad puede formar una solución con agua. El fenol se inflama fácilmente, es corrosivo y sus gases son explosivos en contacto con la llama. El producto comercial es un líquido. Tiene un olor repugnantemente dulce y alquitranado
Propiedades quimicas
- Densidad: 1070 kg/m3 o 1,07 g/cm3.
- Masa molar: 94,11 g/mol.
- Punto de fusión: 40,5 °C o 314 K.
- Punto de ebullición: 181,7 °C o 455 K).
- Incoloro o con color blanco.
- Acidez: 9,95 pKa.
- Solubilidad:3 g/100 ml a 20 °C.
- Momento dipolar: 1,7 D.
- Número CAS: 108-92-2
El fenol se usa principalmente en la producción de resinas fenólicas. También se usa en la manufactura de nylon y otras fibras sintéticas. El fenol es muy utilizado en la industria química, farmacéutica y clínica como un potente fungicida, bactericida, antiséptico y desinfectante, también para producir agroquímicos, policarbonatos, en el proceso de fabricación de ácido acetilsalicílico (aspirina) y en preparaciones médicas como enjuagadientes y pastillas para el dolor de garganta.
Los usos de los fenoles como fungicida o producto para eliminar hongos y microorganismos son muy extendidos. Al mismo tiempo que tienen propiedades para evitar la aparición de hongos también funcionan contra parásitos y bacterias. Sus propiedades también son antisépticas, así que sirven como desinfectantes en sectores como el farmacéutico, para aplicarlos en agricultura o dentro de un tratamiento médico, ver sus beneficios como desinfectante.
El fenol se presenta en la Naturaleza en la madera y en las agujas de pino, en la orina de los herbívoros (fenolsulfato) y en el alquitrán de hulla. Puede sintetizarse mediante la Oxidación parcial del Benceno. El fenol se obtiene a partir de la destilación del alquitrán de hulla. Según RÖMPP 1983, con 1 tonelada de hulla se obtiene aproximadamente 0,25 kg de fenol Actualmente, predomina la producción sintética por disociación del Hidroperóxido de cumeno, obteniéndose acetona como producto secundario
1. Para nombrar los alcoholes Se busca la cadena más larga que incluya el Grupo Hidroxilo. La terminación o del hidrocarburo se cambia por -o
2. Cuando el grupo alcohol es sustituyente, se emplea el prefijo hidroxi-. Se utilizan los sufijos diol, -triol... según la cantidad de grupos OH que se encuentre.
3. Cuando el alcohol no es el grupo funcional principal se nombra como hidroxi, precedido de su número localizador
4. Para nombrar los fenoles se utiliza la terminación -ol precedida del nombre del hidrocarburo aromático correspondiente.
5. Si existen varios radicales -OH en los fenoles, se numeran los átomos de carbono del benceno de modo que los carbonos con grupos hidroxilo les corresponda la numeración más baja


FALTARON ALGUNOS EJERCICIOS 4,5
ResponderBorrar